Los colorantes aminorreactivos de viabilidad, conocidos comercialmente como “Fixable Viability Stains (FVS)”, constituyen una estrategia avanzada para la discriminación de células vivas y muertas en citometría de flujo multicolor. Estos colorantes reaccionan de forma covalente con grupos amina primarios presentes en proteínas celulares, lo que permite una diferenciación clara y reproducible entre poblaciones celulares viables y no viables (Perfetto et al., 2006).
En células viables, la reacción se limita mayoritariamente a aminas de superficie, generando una señal fluorescente muy baja. En contraste, en células no viables o muertas el colorante penetra al citoplasma y se une a un gran número de aminas intracelulares, produciendo una señal intensa y claramente separable de la población viable (Perfetto et al., 2006).
Una de las principales ventajas demostradas de este enfoque es la estabilidad irreversible de la tinción, lo que permite someter las muestras a procesos de fijación y permeabilización sin pérdida significativa de la fluorescencia. El estudio de Perfetto et al. demostró que la fluorescencia de estos colorantes se conserva después de tratamientos estándar con fijadores como el paraformaldehído y reactivos de permeabilización, superando una limitación crítica de marcadores tradicionales como el 7-AAD o el yoduro de propidio (PI), cuya señal se pierde o se altera tras la fijación.
Desde el punto de vista analítico, los colorantes aminorreactivos muestran una alta correlación con marcadores clásicos de muerte celular como la Anexina V. Sin embargo, presentan mayor sensibilidad, identificando poblaciones celulares que sufren degradación de ADN o pérdida del núcleo y que con un colorante como PI no se detectó fluorescencia. Estas células, aunque altamente dañadas, aún pueden unirse a anticuerpos y no ser excluidas adecuadamente con colorantes intercalantes de ADN (Perfetto et al., 2006).
El impacto práctico de esta exclusión es particularmente evidente en paneles multicolor complejos. En experimentos de hasta 12 colores realizados por Perfetto et al., la inclusión de células muertas se asoció con perfiles fenotípicos aberrantes y un incremento artificial del ruido en ensayos funcionales. La exclusión sistemática de células no viables mediante colorantes aminorreactivos redujo significativamente estos artefactos y mejoró la sensibilidad global del ensayo (Perfetto et al., 2006).
En línea con estos hallazgos, BD Biosciences ha desarrollado la familia de colorantes BD Horizon™ Fixable Viability Stain, una gama de colorantes de viabilidad fijables diseñados específicamente para citometría de flujo multicolor de alta complejidad. Estos reactivos se basan en el mismo principio de reactividad con grupos amina descrito en la literatura científica y ofrecen (BD Biosciences, 2016):
- Discriminación clara y confiable de células vivas y muertas.
- Compatibilidad con protocolos de fijación y permeabilización, permitiendo su uso en múltiples aplicaciones posteriores.
- Retención estable de la fluorescencia en células fijadas y resistencia a la criopreservación.
- Disponibilidad de nueve reactivos distintos, que brindan mayor flexibilidad en el diseño de paneles multicolor para los láseres violeta (FVS450, FVS510 y FVS575V), azul (FVS520), verde-amarillo (FVS570 y FVS620, también excitables con el láser azul) y rojo (FVS660, FVS700 y FVS780).
Los reactivos BD Horizon FVS son colorantes reactivos a aminas que discriminan células mamíferas viables de no viables en función de la intensidad de fluorescencia. En términos cuantitativos, las células muertas suelen presentar una intensidad fluorescente 10 a 20 veces mayor que las células vivas teñidas con la misma concentración de colorante. Las células apoptóticas pueden mostrar una señal intermedia o variable, por lo que su identificación se optimiza mediante la combinación de un FVS con marcadores específicos de apoptosis (BD Biosciences, 2016).
Adicionalmente, estos reactivos pueden emplearse en ensayos de tinción intracelular que utilizan alcoholes o detergentes para la permeabilización, como los buffers BD Phosflow™, la solución BD Cytofix/Cytoperm™ y el buffer para factores de transcripción BD Pharmingen™. Las células marcadas pueden fijarse, congelarse y almacenarse sin pérdida significativa de señal, lo que facilita la estandarización y el trabajo en estudios multicéntricos o diferidos en el tiempo (BD Biosciences, 2016).
En conjunto, estas características posicionan a los BD Horizon™ Fixable Viability Stains como una herramienta estratégica para laboratorios clínicos y de investigación que buscan maximizar la precisión analítica, la robustez metodológica y la estandarización de sus ensayos citométricos en entornos de alta complejidad (BD Biosciences, 2016).
En el siguiente ejemplo presentado por BD Biosciences (2016) se evidencia que las células Jurkat teñidas con FVS780 muestran dos poblaciones que abarcan células vivas/apoptóticas (dim) y células muertas (bright). Sin embargo, las células Jurkat teñidas con FVS450 muestran tres poblaciones: células vivas (dim), apoptóticas (intermedias) y muertas (bright), como se confirmó mediante la cotinción con Anexina V (Figura 1).
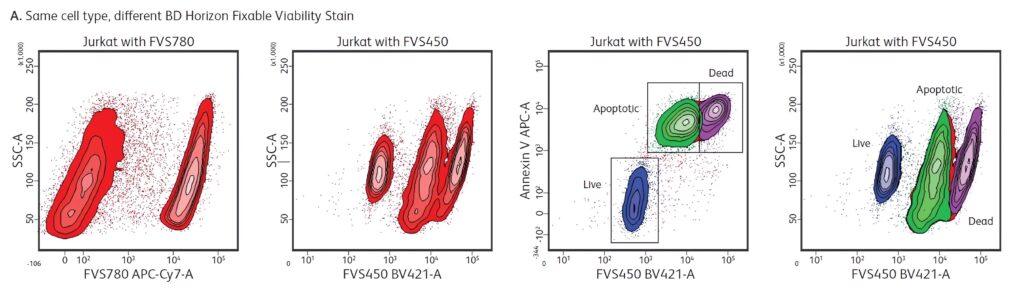
Figura 1. Tinción de células Jurkat con FVS780, FVS450 y cotinción con Anexina V.
La unión de los Fixable Viability Stains a las células apoptóticas es, por tanto, dependiente del colorante y del tipo celular, y se recomienda la cotinción con un marcador de apoptosis, como Anexina V o Anti-Caspasa-3 activa, para resolver e identificar adecuadamente las células apoptóticas. Esta cotinción no es necesaria si el único objetivo es eliminar las células muertas del análisis (BD Biosciences, 2016).
Referencias Bibliográficas
- BD Biosciences. (2016). BD Horizon™ Fixable Viability Stain (FVS) reagents [Technical Data Sheet]. Becton, Dickinson and Company. https://www.bdbiosciences.com/content/dam/bdb/marketing-documents/Horizon-DS-Fixable-Viability-Stain-Reagents.pdf
- Perfetto, S. P., Chattopadhyay, P. K., Lamoreaux, L., Nguyen, R., Ambrozak, D., Koup, R. A., & Roederer, M. (2006). Amine reactive dyes: An effective tool to discriminate live and dead cells in polychromatic flow cytometry. Journal of Immunological Methods, 313(1–2), 199–208. https://doi.org/10.1016/j.jim.2006.04.007