La homeostasis de los tejidos se mantiene mediante el balance entre la proliferación celular y la apoptosis. La proliferación celular es el aumento del número de células como resultado del crecimiento y la división celular, mientras que la apoptosis es un proceso fisiológico que lleva a una muerte celular programada y controlada. Una larga lista de enfermedades ha sido asociada al malfuncionamiento de estos procesos, dentro de las que se destacan enfermedades degenerativas como el Alzheimer, enfermedades proliferativas como el cáncer, e incluso desórdenes autoinmunes, entre otros (Zamora et al., 2005; BD Biosciences, 2015).
Las características de las células apoptóticas difieren de las que se observan en otros mecanismos de muerte celular como la necrosis. En la apoptosis, se observan características morfológicas como cambios en la membrana plasmática que llevan a una pérdida de simetría y pérdida de adherencia, alteraciones del citoesqueleto que lleva a un encogimiento celular, una condensación del citoplasma y del núcleo, fragmentación de proteínas y del ADN (Zamora et al., 2005; BD Biosciences, 2015).
El proceso de la apoptosis se lleva a cabo en diferentes fases altamente reguladas molecularmente. La fase inicial se producen los mecanismos moleculares que inician el fenómeno; en la siguiente fase se fragmenta el ADN; en las fases finales se produce la destrucción nuclear y citoplasmática, y los restos son fagocitados por macrófagos sin causar daño inflamatorio a las células circundantes. En cambio, en la necrosis la muerte celular ocurre de forma descontrolada produciendo reacciones patológicas que llevan a un daño celular severo incluso en las células circundantes (Solé, 1995; BD Biosciences, 2015).
Sin embargo, algunos tipos celulares no exhiben las características típicas de la apoptosis. En estos casos, es fundamental analizar varios aspectos del proceso para confirmar el mecanismo de la muerte celular. La citometría de flujo es una herramienta altamente eficaz para detectar la apoptosis, ya que permite obtener datos cuantitativos sobre células en apoptosis y muertas dentro de poblaciones completas, así como en diferentes subpoblaciones. BD ofrece una amplia gama de herramientas y tecnologías especializadas en la detección de apoptosis, que permiten medir indicadores en distintas fases del proceso apoptótico, así como reactivos para identificar diferentes subpoblaciones celulares (BD Biosciences, 2015).
Dentro de los kits que BD ofrece para el estudio de la apoptosis se detallan los siguientes:
Kit BD™ MitoScreen (JC-1)
Una vez que comienza la apoptosis, se producen cambios en el potencial de membrana mitocondrial (Δψm), los cuales se pueden medir por citometría de flujo. El aumento en el Δψm conlleva un incremento en la permeabilidad de la membrana mitocondrial, lo que provoca la liberación de proteínas solubles, como citocromo C y pro-caspasas que llevan a la activación de la cascada apoptótica (BD Biosciences, 2015).
La citometría de flujo se ha consolidado como una herramienta eficaz para el análisis del Δψm al utilizar fluorocromos catiónicos lipofílicos permeables a la membrana, como el 5,5′,6,6′-tetra-cloro-1,1′,3,3′-tetraetilbenzimidazolcarbocianina yodada (JC-1). Este fluorocromo puede existir en dos estados diferentes: agregados o monómeros, cada uno con un espectro de emisión diferente. Los monómeros de JC-1 se forman a bajas concentraciones del fluorocromo, mientras que los agregados se producen a concentraciones más altas (BD Biosciences, 2014).
Cuando las células vivas se incuban con JC-1, este penetra la membrana plasmática de las células como monómeros. La captación de JC-1 en las mitocondrias es impulsada por el Δψm. El Δψm de las mitocondrias sanas y normales está polarizado, y el JC-1 es rápidamente absorbido por dichas mitocondrias. Esta absorción aumenta el gradiente de concentración de JC-1, lo que lleva a la formación de agregados de JC-1 dentro de las mitocondrias. JC-1 no se acumula en mitocondrias con Δψm despolarizado y permanece en el citoplasma como monómeros (BD Biosciences, 2014).
Por un lado, tanto los monómeros como los agregados de JC-1 exhiben fluorescencia en el extremo verde del espectro, que se mide en el canal verde (FL-1). Por otro lado, los agregados de JC-1 presentan un desplazamiento espectral hacia el rojo, lo que genera una mayor emisión de fluorescencia roja, que se mide en el canal rojo (FL-2) en la mayoría de los citómetros de flujo. Aunque la fluorescencia de JC-1 se ve en ambos canales (FL-1 y FL-2) en células sanas, el patrón de tinción de JC-1 puede variar según el tipo o la línea celular (BD Biosciences, 2014).
Un Δψm despolarizado indica una alteración en la función mitocondrial, lo cual puede deberse a apoptosis o a otros procesos celulares como la autofagia o la senescencia. Los monómeros de JC-1 no muestran el desplazamiento espectral hacia el rojo y, por lo tanto, tienen una fluorescencia reducida en el canal FL-2. La formación de agregados de JC-1 es reversible. Así, en mitocondrias que pasan de un Δψm polarizado a uno despolarizado, el JC-1 se filtra fuera de las mitocondrias hacia el citoplasma en forma de monómeros, lo que da como resultado una disminución de la fluorescencia roja (BD Biosciences, 2014).
Kit de ensayo de Caspasa-3 BD Pharmingen™ y PE Mouse Anti-Cleaved PARP (Asp214) BD Pharmingen™
Las caspasas son una familia de proteasas de cisteína que tienen un rol clave en la apoptosis y la inflamación. La caspasa-3 es una proteasa clave que se activa en las etapas tempranas de la apoptosis. Al igual que otros miembros de esta familia, se sintetiza inicialmente como una proenzima inactiva que se procesa en las células en apoptosis mediante autoproteólisis y/o escisión por otra proteasa.
La caspasa-3 activada es una caspasa efectora que, a su vez, activa otras caspasas, así como a otras proteínas importantes en la apoptosis como el BCL-2 y a la Poli-ADP ribosa polimerasa (PARP). BCL-2 protege a las células de la apoptosis al asociarse con la membrana mitocondrial y previene la liberación de citocromo C desde las mitocondrias. En contraste, otros miembros de la familia BCL-2, como Bax, promueven la apoptosis. Las PARPs son enzimas de reparación del ADN que se activan por rupturas en las hebras de ADN. La escisión de PARP por caspasa-3 en fragmentos de 24 y 89 kDa inactiva esta enzima.
Este kit contiene un anticuerpo diseñado para reconocer a la caspasa-3 activada humana. Además, BD ofrece otros anticuerpos específicos para detectar los productos de escisión de PARP que son marcadores útiles de apoptosis. Estos anticuerpos están disponibles en una variedad de formatos y pueden combinarse con otros marcadores para obtener información adicional sobre la célula (BD Biosciences, 2015).
Kit de detección de Apoptosis Anexina V BD Pharmingen™
Este kit detecta la externalización de las moléculas de fosfatidilserina (PS) en la membrana plasmática, una de las primeras señales del proceso apoptótico. Normalmente la PS se localiza en la cara interna de la membrana celular, pero durante la apoptosis, esta es traslocada a la membrana externa y puede detectarse mediante citometría de flujo al unirse a la Anexina V marcada con un fluorocromo. BD ofrece varios formatos de Anexina V conjugada a FITC, PE, BV421 y otros fluorocromos BD Horizon BrilliantTM Violet para el láser violeta y BUV395 para el láser ultravioleta (BD Biosciences, 2013).
Debido a que la Anexina V intracelular también se expone cuando la membrana citoplasmática se ve comprometida, en este kit se incluye además un colorante vital como el yoduro de propidio (PI) o la 7-Amino-Actinomicina (7-AAD) para distinguir entre las células apoptóticas de las células muertas. La población de células teñidas únicamente con Anexina V representa a la población de células apoptóticas tempranas, mientras que la población de células muertas es positiva tanto para Anexina V como con 7-AAD o PI (Figura 1) (BD Biosciences, 2015).
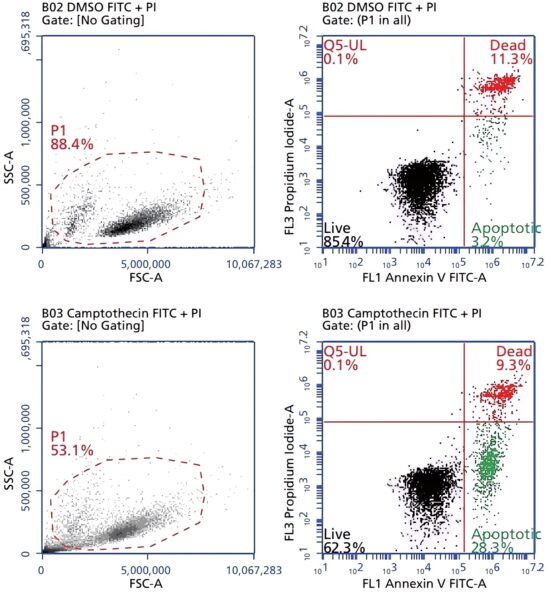
Figura 1. Análisis con el BD Accuri™ C6 del kit de detección de Apoptosis Anexina V BD Pharmingen™
Kit APO-BRDU BD Pharmingen™
Uno de los últimos pasos de la apoptosis consiste en la fragmentación del ADN, un proceso que resulta de la activación de endonucleasas durante la cascada apoptótica. Estas nucleasas degradan a la cromatina en fragmentos de aproximadamente 300 kb y, posteriormente, en fragmentos más pequeños de alrededor de 50 pb de longitud (BD Biosciences, 2017).
Este método emplea una reacción catalizada por la enzima TdT (desoxinucleotidil transferasa terminal) exógena. TdT cataliza la adición independiente de plantilla de trifosfatos de deoxiuridina bromolada (Br-dUTP), nucleótidos marcados con Br-dUTP a los extremos terminales 3′-hidroxilo (OH-) de las rupturas en el ADN de doble banda o de cadena simple. Luego, estos sitios son reconocidos mediante citometría de flujo al utilizar anticuerpos monoclonales anti-BrdU acoplados a FITC (BD Biosciences, 2017) (Figura 2). El kit APO-BRDU™ es un método de tinción con dos colores para etiquetar rupturas de ADN y al ADN total para detectar células apoptóticas mediante citometría de flujo (BD Biosciences, 2017).
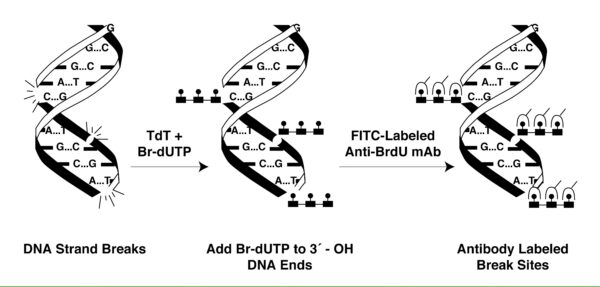
Figura 2. Representación esquemática del etiquetado con APO-BRDU por la enzima TdT y su reconocimiento por anticuerpos anti-BRDU.
Al final de la apoptosis, las células se vuelven no viables. Diferenciar las células apoptóticas de las necróticas o muertas es clave para aislar poblaciones apoptóticas. BD ofrece una variedad de productos de viabilidad para identificar células muertas, incluyendo sondas de actividad esterasa y colorantes de la integridad de membrana.
Con la gran cantidad de técnicas y productos disponibles, elegir el método más adecuado suele ser difícil. Para facilitar esta elección, BD resume estos y otros ensayos disponibles comercialmente desde una perspectiva biológica en el siguiente enlace: https://www.bdbiosciences.com/en-eu/learn/research/cell-biology/apoptosis?tab=Apoptosis-Tools-and-Resources.
Referencias Bibliográficas
- BD Biosciences. (2013). BD Apoptosis Kits and Templates.
- BD Biosciences. (2014). BDTM MitoScreen Flow Cytometry Mitochondrial Membrane Potential Detection Kit Instruction Manual.
- BD Biosciences. (2015a). Tools for Assessing Cell Events: Apoptosis, Cell Cycle, and Cell Proliferation.
- BD Biosciences. (2015b). BD PharmingenTM PE Active Caspase-3 Apoptosis Kit Product Information. www.bdbiosciences.com/pharmingen/protocols
- BD Biosciences. (2017). BD PharmingenTM APO-BRDUTM Kit Product Information APO-BRDUTM Kit Part A APO-BRDUTM Kit Part B.
- Solé FJ, Chechile G, Algaba F, Villaviciencio H, Cordon C (1995). Regulación del ciclo celular. Bases moleculares de la carcinogénesis. Biología molecular de los tumores urológicos.61-66
- Zamora S, Juan Diego, Otárola A, Isabel C, & Brenes G, Oscar. (2005). La apoptosis y su relación con diversos nutrientes. Revista chilena de nutrición, 32(3), 178-190. https://dx.doi.org/10.4067/S0717-75182005000300002