Importancia del Genotipeo del Virus del Papiloma Humano
La infección por el Virus del Papiloma Humano (VPH) es la infección de transmisión sexual más frecuente a nivel mundial. El virus ha sido identificado como un agente carcinogénico, con una preponderancia importante en cáncer cervical, de pene, vulva, vagina, ano y orofaringe. Actualmente, se considera que el 100% de los casos de Carcinoma Uterino Cervical se derivan de la infección a partir de un genotipo de alto riesgo del virus VPH (Forman et al., 2012).
Historia Natural de la infección por VPH
Existen hasta 200 genotipos del virus del Papiloma Humano. De estos, doce genotipos (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 y 59) se han caracterizado como genotipos de alto riesgo para el desarrollo del cáncer en seres humanos, según la Agencia Internacional de Investigación sobre el Cáncer (Sendagorta-Cúdos et al., 2019). Los genotipos 6 y 11 se han clasificado de bajo riesgo, y se relacionan a la presencia de lesiones benignas como condilomas. En tanto, se estudia el papel de otros genotipos, los cuales se denominan como “´posiblemente cancerígenos”.
El Virus del Papiloma Humano tiene capacidad de infectar la capa basal del epitelio de distintas zonas del organismo (Fig. 1). En el caso del cérvix, el virus ingresa gracias a las posibles micro abrasiones presentes en esa zona. El virus mantiene un numero bajo de copias en las células recién infectadas. Sin embargo, una vez que estas células se diferencian, el virus empieza a replicarse de manera rápida, y expresa los genes tempranos L1 y L2 de cápside, lo que resulta en la producción de viriones que se liberan en la superficie epitelial (Sendagorta-Cudós et al., 2020).
Un alto porcentaje de las infecciones se aclaran espontáneamente, con una media de 8 meses. Sin embargo, en algunos pocos casos la infección puede mantenerse por años, lo cual se denomina Infección Persistente. Este tipo de infecciones pueden progresar a lesiones precancerosas, denominadas CIN (neoplasia cervical intraepitelial): los genotipos de alto riesgo del virus son más propensos a incidir en este tipo de lesiones. Los oncogenes E6 y E7 del virus tienen un papel importante en la proliferación celular. Estos genes se pueden encontrar en los genotipos de bajo y alto riesgo del virus.
Durante todo este tipo, el virus mantiene un bajo perfil para no ser detectado por el sistema inmune. Una de las estrategias es que el virus se mantiene exclusivamente en el epitelio de la zona afectada, sin entrar en ciclo lítico, para evitar la señal inflamatoria asociada. Por lo tanto, el reclutamiento de células presentadoras de antígenos y la liberación de citoquinas es nula o muy baja, posterior a la infección por VPH. Debido a la poca respuesta inmunogénica, la persona no está protegida de reinfecciones de un genotipo diferente o incluso del mismo.
El virus puede integrarse en la célula hospedera, lo que favorece el proceso carcinogénico, y con ello una expansión clonal que derive en Cáncer Cervical (Sendagorta-Cudós et al. 2020). Es importante destacar que, en este punto, los genes E6 y E7 pueden ser detectados en las lesiones epiteliales relacionadas al VPH; sin embargo, los genes L1 y L2 ya no son detectables.
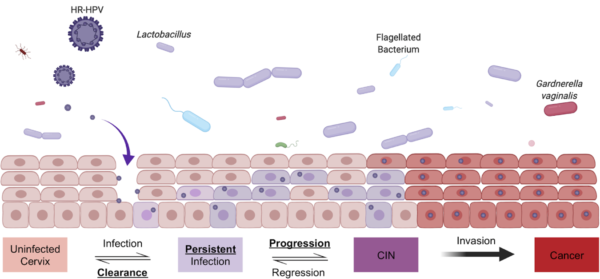
Fig. 1. Historia Natural de la infección causada por el Virus del Papiloma Humano en el epitelio cervical. (Usyk et al. 2020).
Epidemiología
A nivel mundial, el cáncer cervical ocupa el cuarto lugar en frecuencia en mujeres, con un total de 570 mil nuevos casos en el 2018. Se estima que se presentan 311 mil muertes anuales derivadas de este cáncer (WHO, 2020). En Costa Rica, el cáncer cervical representa el 11% de casos nuevos de cáncer en la población femenina, según datos del 2014 del Ministerio de Salud. Estos números son altos, considerando que el cáncer cervical se podría prevenir con años de anticipación, debido a que se conoce el agente causal, existen buenos sistemas de tamizaje y vacunas. Sin embargo, la inequidad en el acceso a los recursos repercute en la alta incidencia, prevalencia y mortalidad de la enfermedad.
Tamizaje temprano de Cáncer Uterino
La técnica de tamizaje es la citología convencional de células epiteliales del Cérvix, utilizando la técnica Papanicolau (PAP). En los pacientes con resultado “células escamosas atípicas de resultado indeterminado”, también denominado ASCUS, u otro resultado contundente, se aplica la técnica de Colposcopia y/o Biopsia. Sin embargo, la sensibilidad del Papanicolau es baja, como se ha evidenciado en diversos estudios. Terrazas (et al., 2015) evidencia que la sensibilidad del Papanicolau para la detección de Neoplasia Cervical Intraepitelial grado dos (CIN+2) en una población de mujeres en Chile, es de apenas el 22.0%, en comparación con el 92.7% de sensibilidad de una prueba molecular. La sensibilidad del PAP se relaciona con la calidad de la muestra y la interpretación del frotis, entre otros.
Terrazas et al. (2015) identificó en su estudio que 0.6% de las mujeres evaluadas presentaron la prueba de PAP positiva, en comparación con el 9.6% mujeres con prueba molecular positiva para VPH, y 1.1% ambos exámenes positivos. Basado en esta información, Terrazas sugiere realizar un cambio en el algoritmo de tamizaje de Cáncer Cervical, en donde se aplique como tamizaje primario el screening molecular, y la prueba de PAP solo aquellas muestras que resulten positivas a la prueba inicial, lo que permitiría aumentar la calidad y testeo de la citología. Así mismo, se pueden implementar estrategias de estratificación para las muestras con VPH positivo, basado en el genotipo detectado. En un meta-análisis realizado por Bonde et al. (2020), se denota que poseer los genotipos 16, 18, 31 y 33 acarrea un riesgo alto de desarrollar una Neoplasia Cervical Intraepitelial grado tres (CIN +3). Los genotipos 52, 58 y 45 acarrean un riesgo moderado, en tanto los genotipos 35, 39, 51, 56, 59, 66 y 68 presentan el menor riesgo. Esta estratificación permite un manejo de los recursos, diferenciando entre los pacientes que deben ser intervenidos de inmediato, y aquellas que no requieren una intervención pronta debido al genotipo del virus que presentan, al tiempo que evita la congestión de los servicios especializados de ginecología y permite una atención más adecuada.
Es importante destacar que la metodología de screening debe contemplar, de preferencia, la detección de los genes E6 y E7 debido a que aumenta la sensibilidad de la prueba. Los genes L1/L2 se pierden durante la integración del genoma viral a la célula; en cambio, los genes E6/E7 son primordiales para el desarrollo del cáncer, por lo que se mantienen durante todo el ciclo de vida del virus. Si se utiliza como marcador los genes E6/E7, todos los estadios de la enfermedad, incluido el cáncer, pueden ser detectados, incluso en aquellos casos donde los genes L1/L2 hayan sido eliminados (Tjalma & Depuydt, 2013).
La tecnología BD Onclarity permite la detección separada de los genotipos 16, 18, 31, 45, 51 y 52, así como la identificación en cluster de ocho otros genotipos de alto riesgo, mediante la detección de los oncogenes E6 y E7. Contáctenos en caso de requerir más información.
Referencias bibliográficas
- Bonde et al. 2020. Clinical Utility of Human Papillomavirus Genotyping in Cervical Cancer Screening: A Systematic Review. Journal of Lower Genital Tract Disease; 24, 1.
- Forman et al. 2012. Global Burden of Human Papillomavirus and Related Diseases. Vaccine 30S: F12– F23
- Sendagorta-Curdós et al. 2019. Infecciones genitales por el virus del papiloma humano. Enferm Infecc Microbiol Clin.;37(5): 324–334.
- Terrazas et al. 2015. Examen de detección de virus papiloma humano en el tamizaje de cáncer cervicouterino en un Servicio de Salud de Santiago, Chile. Rev Med Chile; 143: 56-62.
- Tjalma & Depuydt, 2013. Cervical cancer screening: which HPV test should be used—L1 or E6/E7?. European Journal of Obstetrics & Gynecology and Reproductive Biology; 170:45–46.
- Usyk et al. 2020. Cervicovaginal microbiome and natural history of HPV in a longitudinal study. PLoS Pathog 16(3): e1008376. https://doi.org/10.1371/journal.ppat.1008376.